Question 1
Pour ralentir l’évolution d’une réaction chimique, on peut :
augmenter la concentration des réactifs.
diminuer la température.
diluer le mélange réactionnel.
Question 2
Un catalyseur :
diminue la durée d’une réaction chimique.
n’apparaît pas dans l’équation de réaction.
modifie l’état final du système chimique.
Question 3
La vitesse volumique de disparition d’un réactif :
s’exprime en m·s–1.
est sans unité.
est positive.
Question 4
Les vitesses d’apparition de tous les produits dans une réaction non catalysée et à température constante :
sont toutes égales.
restent constantes au cours du temps.
diminuent au cours du temps.
Question 5
Pour une réaction chimique totale, le temps de demi-réaction représente :
la moitié de la durée totale de la réaction.
la durée nécessaire à la consommation de la moitié de la quantité initiale du réactif en excès.
la durée au bout de laquelle la moitié de la quantité finale des produits est apparue.
Question 6
Pour une réaction d’ordre 1 par rapport à un réactif A, la vitesse de disparition de A est :
égale à  .
.
égale à 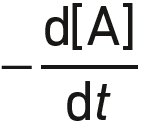 .
.
proportionnelle à la concentration [A].
Question 7
Pour une réaction d’ordre 1 par rapport à un réactif A :
la courbe de ln([A]) en fonction de ln(
la courbe de [A] en fonction de
la courbe de ln([A]) en fonction de
Question 8
La concentration en réactif A d’une réaction d’ordre 1 a pour expression  .
.
La constante de vitesse
La constante de vitesse
Le temps de demi-réaction  .
.
Question 9
Un mécanisme réactionnel :
décompose une réaction en actes élémentaires.
ne fait intervenir que les réactifs et produits de la réaction.
présente des actes élémentaires dans un ordre quelconque.
Question 10
Un acte élémentaire :
résulte d’un choc efficace entre deux réactifs.
peut produire une espèce absente dans l’état initial et dans l’état final.
ne peut jamais faire intervenir un catalyseur.
Question 11
Un site donneur de doublet :
est toujours ion négatif.
est situé à la pointe d’une flèche courbe.
peut être un doublet non liant.
Question 12
Plus la fréquence des chocs entre les réactifs est grande :
plus la réaction est lente.
plus la durée de la transformation est courte.
plus le nombre d’étapes du mécanisme est grand.
 QCM
QCM